穩定性同位素在藥物開發和定制化醫學中的應用----阿拉丁試劑
穩定性同位素在藥物開發和定制化醫學中的應用: 揭示生物標記與動力學生化網絡的奧秘

在新興的定制化醫療時代,穩定同位素標記與強大的質譜分析技術的結合正在為藥物開發和臨床診斷提供越來越重要的診斷工具。
問題:當代藥物開發中的高流失率
雖然人們普遍認為我們生活在一個新藥研發生產突破的黃金時代,但事實恰恰相反。近年來,盡管制藥行業投資大幅增加,但新藥批準率仍達到了一直以來的最 低水平[1]。這些令人失望的情況適用于所有類別的疾病,但尤其令人擔憂的是日益流行的慢性疾病,如阿爾茨海默病、糖尿病、骨關節炎和肥胖相關疾病。
這個問題的出現不在于缺乏分子靶點或候選藥物。基于分子靶點的藥物發現方法在過去20年的藥物研究中占據主導地位,它產生了大量的基因、蛋白質和潛在的藥物療法。問題是藥物線索的減損率變得更糟,而不是更好,現在98%的線索由于療 效或安全性原因而失效,包括人體試驗中90%的失敗率[2,3]。這種減損在很大程度上導致了最 終批準的每一種成功藥物的高成本。
藥物復雜網絡中的難以預測性
藥物線索的減損,其主要原因是由生命系統組成的復雜網絡的不可預測性組成的,而這些網絡是對特定節點的針對性干預措施做出反應的[2],在這些系統中,有針對性的干預措施會帶來意想不到的功能后果(可能是有害或者是有益的),這是非常常見的情況而非特例(圖1)。每種疾病中個體之間的致病異質性放大了這一問題,因此需要針對不同患者亞群采取不同的干預策略。后一個問題體現在私人定制化醫療的理念上。
圖1:藥物復雜網絡中的難以預測性。
缺失的一環:探索疾病復雜生物學的指標
在了解疾病的復雜生物學過程中,關鍵缺失的因素是指導藥物研發人員朝著安全有效結局目標前進的客觀指標[4]。這些指標被稱為生物標記物,必須能夠預測臨床結局,并且可以從臨床前模型轉化到人類。實現這些目標的最可靠方法是捕獲驅動每種疾病的基礎生物學過程(即疾病修飾通路或基礎發病機制)。這類指標可用于指導合理的藥物發現和開發,并用于監測臨床應答情況。
“定制化醫學”領域對功能信息生物標記物的需求最 大,即正確的患者、正確的藥物、正確的時間和正確的劑量。伴隨診斷檢查是這一趨勢的價值極高的例子。
穩定性同位素對于一類新型生物標記物至關重要:通過揭示基礎疾病過程的功能可解讀信息來預測臨床檢測的結果
我們需要能夠預測臨床結果的一類新型生物標記物[4,5]。構成慢性疾病基礎的生物學通路(負責疾病啟動、進展、嚴重程度和治 療逆轉的因果過程)通常涉及分子流動,而這一通路本身復雜,且受到許多因素的影響(圖2)[5-8]。穩定同位素技術已使所有這些因果通路在高等生物中可測量。
圖2:通路通量作為分子靶點和臨床結果之間的聯系。
穩定同位素為診斷生物標記物帶來了什么
穩定同位素允許測量通過代謝途徑的通量和全 球生化網絡的動態,且無毒性,通常無創,原因有二:第 一 ,穩定同位素的實驗性施用在時間維度上引入了“不對稱”(本身沒有標記,隨后加入標記),這使得動態過程耗費的時間可以被測量;其次,過去一個世紀的生化研究已經建立了連接細胞和生物體分子的途徑,使得標記底物在體內的運動行為得以被追蹤。
重要的是,穩定同位素已經在人類和實驗動物中使用了70多年,幾乎沒有已知的毒性。FDA對穩定同位素標記產品的政策是明確的,并且幾十年來一直是一致的:除了管理其天然豐度同系物(無菌性、無熱原性等)所需的審批之外,管理穩定同位素標記的化合物不需要任何監管批準。需要注意的是,穩定同位素質譜生物標記物不是放射成像技術,但需要來自身體的樣本(血液、尿液、腦脊液、組織、唾液)。
兩大類基于穩定同位素的可用動力學生物標記物
有兩大類基于穩定同位素的生物標記物,它們在藥物開發和診斷中是最有用的:(1)靶向因果途徑的動力學,以及(2)網絡動力學的研究,以無偏倚地發現動力學特征和其無法被預測的因果途徑。這兩種類型在藥物發現和開發中都是有效的[5-15]。
作為藥物發現和開發生物標記物的靶向因果通路動力學
表1列出了疾病致病途徑的一些常見例子。其中包括:纖維化疾病中膠原和細胞外基質的合成;多發性硬化的髓鞘合成和代謝;阿爾茨海默病中淀粉樣斑塊的周轉和淀粉樣β1-42的合成;肌少癥患者肌肉肌球蛋白合成及線粒體生物發生的研究腫瘤血管生成與腫瘤細胞增殖和死亡;在神經退行性疾病中通過軸突運送分子;亨廷頓病、帕金森病和其他以蛋白質聚集為特征的疾病中的自噬流;血栓栓塞性疾病中的凝塊形成和溶解;胰島素抵抗狀態下胰島素介導的葡萄糖攝取與胰島β細胞增殖肥胖時脂肪組織脂質動力學及重塑;動脈粥樣硬化中的膽固醇逆向轉運;炎癥狀態下補體級聯的激活;艾滋病患者的HIV復制和CD4+ T細胞的轉換等其他案例。
測量被認為在疾病中起因果作用的任何功能相關過程的活動的能力,對這些領域的藥物發現和開發具有潛在的變革作用(如帕金森病)[10,11]。
A) 神經生物學 | ||
通過軸突進行的遞送 | 淀粉樣β蛋白合成和斑塊周轉 | 神經發生 |
髓鞘形成/髓鞘再生 | 神經遞質釋放和周轉 | 神經元線粒體生物發生 |
神經炎癥,小膠質細胞的活化 | 細胞因子釋放 | 亨廷頓蛋白周轉 |
朊病毒的周轉 | 突觸可塑性 | |
B) 肥胖/II型糖尿病 | ||
胰 腺β細胞增殖 | 胰島素介導的葡萄糖攝取 | 肝葡萄糖的生成 |
脂肪生成和TG沉積 | 脂肪組織重塑 | 脂肪組織脂肪酸氧化/棕色脂肪轉化 |
動脈粥樣硬化、膽固醇清除和沉積 | 脂肪組織巨噬細胞增殖和活化 | 肌肉線粒體β-氧化和生物發生 |
肝臟TG的合成與釋放 | ||
C) 癌癥/腫瘤形成 | ||
腫瘤細胞增殖和死亡率 | 血管新生 | 淋巴管生成/轉移擴散 |
DNA甲基化/脫甲基 | 核糖核苷酸還原酶活性 | 組蛋白去乙酰化 |
癌前進化到侵襲性表型 | 腫瘤特異性T細胞增殖 | 細胞外基質轉換 |
表1:因果途徑的例子
網絡動力學探究
也許近年來穩定同位素生物標記最令人興奮的進展是“網絡動力學”的出現:對構成生命系統的復雜生化網絡的動態行為進行全面的探究。這已經成功地應用于臨床前模型和人類的全 球蛋白質組動力學或動態蛋白質組學[12,13]。這提供了一種新型的系統生物學,作為生物標記物發現的無偏倚篩選工具具有巨大的潛力。
動態蛋白質組學代表了“組學”技術中功能上最可解釋的技術,不僅提供熱圖或信息學,而且提供功能上可解釋的系統生物學信息。圖3顯示了測量蛋白質組動態的操作流程圖。該方法已成功應用于以下場景,如熱量限制對細胞蛋白穩態的影響,包括線粒體生物發生和線粒體自噬;慢性淋巴細胞白血病腫瘤細胞不良預后的蛋白質組動力學特征區分成功補償肥胖動物胰島素抵抗的胰島和衰竭并變得“疲憊”的胰島;運動對肌肉蛋白質組轉換的影響神經炎癥對腦脊液蛋白質組周轉的影響;血脂異常狀態下高密度脂蛋白(HDL)蛋白質組的動態變化;以及生理學和病理生理學中的其他問題。
圖3:動態蛋白質組學:在體內通過穩定同位素標記測量蛋白質組動力學和濃度。
用于細胞內通路非侵入性生物標記物的“虛擬活檢”方法
組織中蛋白質組動力學的無偏篩選也可以導致發現可在體液中采樣的靶向蛋白質生物標記物。被稱為“虛擬活檢”技術(圖4),這是一種強大的方法,用于測量難以接近的原始組織(如骨骼肌、心臟、大腦、腎臟、肝臟或癌癥組織)中蛋白質合成或蛋白質分解的速率,通過測量可接近的體液(如血液、腦脊液、唾液或尿液)。該方法包括給藥穩定同位素示蹤劑(例如,氧化氘(D, 70%);L-亮氨酸(13C6, 99%);甘氨酸(15N, 98%);螺旋藻全細胞(凍干粉)(U-15N, 98%),代謝并入新合成的蛋白質。然后這些蛋白質逃逸到可接觸的體液中,從中分離并分析同位素含量或模式。所測量的逃逸蛋白的替換率反映了蛋白質在原始組織中的合成或分解率。因此,可以稱作是對原始組織進行了“虛擬活檢”。
虛擬活檢方法可用于發現和驗證生物標記物,用于藥物發現和開發、識別個性化醫療中的疾病子集,以及患者的臨床診斷和管理。這種方法已被開發并應用于基于血液的組織纖維化和骨骼肌蛋白合成測量,以及基于CSF的軸突運輸和神經炎癥測量[10]。一個例子是血漿肌酸激酶MM(來源于骨骼肌),用于從血液測試中測量骨骼肌蛋白合成代謝。還有許多其他的應用可以設想。
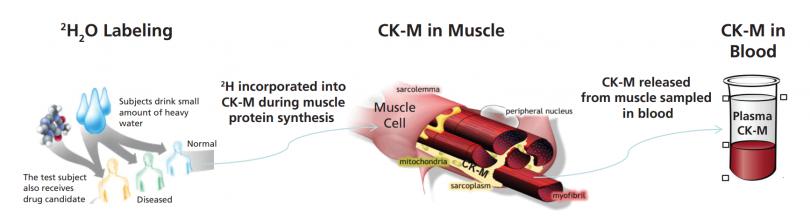
圖4:動態生物標記物的“虛擬活檢”技術。從血漿肌酸激酶M型(CK-M)合成骨骼肌蛋白的案例
原位動力學組織化學:結合組織病理學與穩定同位素和質譜
現在也有可能在組織病理學標本中,在空間上可視化感興趣的目標分子的動力學[14]。將空間組織學信息與分子通量率聯系起來,為病理診斷和疾病監測提供了一個顯著的新維度,這可以通過激光顯微解剖或物理顯微切片來實現(圖5)。在前列腺癌中引入穩定同位素后組織顯微解剖的例子已經發表。例如,前列腺細胞的增殖梯度已被證明與前列腺癌患者活檢標本的組織
學分級密切相關,并通過從精液中分離的前列腺上皮細胞的增殖率反映出來,作為一種潛在的非侵入性生物標記物[14]。
圖5:用于質譜動力學分析的正常和腫瘤組織的顯微解剖。
組織樣本的動力學成像
通過將穩定同位素標記與組織質譜成像相結合,通過基于NIMS或MALDI的組織切片空間可視化,現在可以實現動力學或代謝通量成像。腫瘤模型中空間定義的動力學脂質組學揭示了小鼠乳腺癌模型中與體內侵襲性相關的腫瘤行為的解剖學差異[15]。
穩定同位素生物標記物在藥物開發中的實際應用
基于同位素的穩定生物標記物在藥物發現和開發中有許多用途(表2)。將臨床前研究結果迅速轉化進行人體實驗;“快速殺傷”的代理或類對目標路徑的活性差;確定適當的患者亞群進行治療;確定最 佳劑量、狀態、測量終點和受試者間反應變異性;醫療個性化(伴隨診斷);通過調整劑量來預測毒性或避免毒性。可預測疾病結果的轉譯標記物還允許選擇最 能反映人類疾病的動物模型,或者從藥物開發過程中減少甚至逐漸消除動物模型。
減少推測過程: |
1. 選擇目標; |
2. 選擇化學類別及類別中最 佳化合物; |
3. 確定合適的受試者(排除有毒性風險的無反應亞群); |
4. 為臨床試驗尋找最 佳劑量和方案; |
5. 在患者中選擇終點進行測量和預期的變異性; |
6. 給藥以最大限度地減少毒性; |
7. 測試個性化調整是否能改善反應; |
8. 決定是否提前退出(快速殺傷)。 |
表2:因果路徑指標的應用
基于穩定同位素的動態生物標記物與靜態生物標記物相比具有優勢,同時具有補充作用
傳統的靜態生物標記提供了有關生命系統中分子的濃度、存在或結構的信息。相比之下,動力學生物標記物揭示了通向和離開這些分子的途徑的動態行為。例如,組織中膠原蛋白的數量并不能顯示在疾病環境中或開始治療干預后膠原蛋白合成(成纖維)的速度。線粒體蛋白質的含量也沒有告訴我們線粒體生物發生或線粒體自噬是由干預引起的程度。同樣,腦脊液中蛋白質的濃度也能告訴我們大腦神經元將這種分子通過軸突運送到神經末梢的效率。后一種過程的核心都是分子通過復雜的途徑和網絡流動。
這些致病過程或疾病途徑的活性原則上是與疾病的發生、嚴重程度、進展和治療逆轉最密切相關的指標。如上所述,測量分子通量速率的唯 一方法是引入同位素標簽。雖然靜態參數可以提供關鍵的補充信息,如池大小和分子組分的凈增益或損失,但只能通過動力學測量來揭示潛在致病過程的功能活性。
與靜態“組學”生物標記物相比,同樣的考慮適用于“網絡動力學”,如動態蛋白質組學,但有一個額外的點值得注意。蛋白質的合成和分解速率通常代表細胞或有機體的主動決定,在健康或疾病的背景下,這種決定在功能上是可解釋的。以蛋白質為例,基于泛素蛋白組的去除,轉錄因子刺激的合成,細胞器生物發生過程中的組裝,囊泡中的包裝和分泌,通過未折疊蛋白反應的調節,作為細胞外基質的沉積,作為蛋白質信號級聯的一部分的誘導等等,這些都可以被生理學家、毒理學家和臨床醫生從功能角度考慮。對于蛋白質的簡單存在或濃度并不總是如此。由于內在功能意義和廣泛、無假設篩選之間的結合,動態蛋白質組學是一種特別強大的生物標記物和靶標發現技術。
小結
總之,將基于穩定同位素的生物標記物添加到診斷庫中,為藥物開發帶來了一個新的和迅速擴大的維度。這些生物標記物提供了關于疾病基礎生物學的功能可解釋的決策相關信息,捕捉了驅動疾病和治療的因果途徑的活動。因此,動力學生物標記物可預測臨床應答及其與靶點接觸或臨床治療方案效果的關系。穩定的基于同位素的動力學生物標記物在個性化醫學的新興時代是特別強大的補充。
參考文獻
1. Swann, J.P. 2011. Summary of NDA Approvals & Receipts, 1938 to the present, FDA History Office, http://www.fda.gov/AboutFDA/WhatWeDo/History.
2. Duyk, G. 2003. Attrition and translation. Science, 302(5645), 603-605. https://www.science.org/doi/10.1126/science.1090521
3. Biotechnology Industry Organization (BIO) analysis, 2012.
4. FDA, Innovation or stagnation: challenge and opportunity on the critical path to new medical technologies. March 2004.
5. Hellerstein, M.K. 2008. A critique of the molecular target-based drug discovery paradigm based on principles of metabolic control: advantages of pathway-based discovery. Metab Eng, 10(1), 1-9. https://doi.org/10.1016/j.ymben.2007.09.003
6. Hellerstein, M.K. 2003. In vivo measurement of fluxes through metabolic pathways: the missing link in functional genomics and pharmaceutical research. Annu Rev Nutr, 23, 379-402. https://doi.org/10.1146/annurev.nutr.23.011702.073045
7. Turner, S.M.; Hellerstein, M.K. 2005. Emerging applications of kinetic biomarkers in preclinical and clinical drug development. Curr Opin Drug Discov Devel, 8(1), 115-126. https://www.x-mol.com/paper/1212977911043006473?adv
8. Hellerstein, M.K. 2008. Exploiting complexity and the robustness of network architecture for drug discovery. J Pharmacol Exp Ther, 325(1), 1-9; https://doi.org/10.1124/jpet.107.131276
9. Shankaran, M.; King, C.; Lee, J.; et al. 2006. Discovery of novel hippocampal neurogenic agents by using an in vivo stable isotope labeling technique. J Pharmacol Exp Ther, 319(3), 1172-1181. https://doi.org/10.1124/jpet.106.110510
10. Fanara, P.; Wong, P.Y.; Husted, K.H.; et al. 2012. Cerebrospinal fluid-based kinetic biomarkers of axonal transport in monitoring neurodegeneration, J Clin Invest, 122(9), 3159-3169. https://www.jci.org/articles/view/64575
11. Potter, W.Z. 2012. Mining the secrets of the CSF: developing biomarkers of neurodegeneration. J Clin Invest, 122(9), 3051-3053. https://www.jci.org/articles/view/65309
12. Price, J.C.; Khambatta, C.F.; Li, K.W.; et al. 2012. The effect of long term calorie restriction on in vivo hepatic proteostatis: a novel combination of dynamic and quantitative proteomics. Mol Cell Proteomics, 11(12), 1801-1814. https://doi.org/10.1074/mcp.M112.021204
標簽:激光熔覆技術
全部評論(0條)
推薦閱讀
-

- 穩定性同位素在藥物開發和定制化醫學中的應用----阿拉丁試劑
- 問題:當代藥物開發中的高流失率 雖然人們普遍認為我們生活在一個新藥研發生產突破的黃金時代,但事實恰恰相反。近年來,盡管制藥行業投資大幅增加,但新藥批準率仍達到了一直以來的最 低水平[1]。這些令人失
-

- 磁性納米顆粒在RNA和DNA分離中的應用----阿拉丁試劑
- 在過去的幾十年里,磁性納米顆粒(MNPs)越來越多地用于分離和區分生物分子,這也是目前大多數分子診斷程序的基礎。MNPs的大小、形態和分散性賦予了它們對生物分子的特異性、親和力和結合能力。
-
- 納米顆粒在疫苗遞送中的應用----阿拉丁試劑
- 傳統疫苗可分為四種類型,即減毒活疫苗、滅活疫苗、亞基疫苗、重組疫苗、多糖疫苗和結合疫苗以及類毒素疫苗。雖然這些疫苗中有許多在控制傳染病方面發揮著重要作用,但有些疫苗并不能提供很好的疾病防護,
-
- 白蛋白的應用----阿拉丁試劑
- 白蛋白是人體血漿中最主要的蛋白質,對維持血容量和體液平衡有重要作用。它是一種溶于水且遇熱凝固的球形單純蛋白,分子結構于1975年闡明,其為含585個氨基酸殘基的單鏈多肽,分子形狀呈橢圓形。
-
- ADC藥物在臨床開發中的成功和失敗的經驗教訓
- 抗體藥物偶聯物 (ADC) 由針對特定抗原的單克隆抗體和通過接頭連接的小分子細胞毒性藥物組成。 它們將傳統小分子化療的強大殺傷作用與抗體藥物的腫瘤靶向作用結合起來。 自20世紀90年代中期首次進入臨床試驗以來,經過近30年的發展,ADC已成為非常成功的腫瘤學平臺。C臨床試驗中獲得的成功和失敗的經驗。
-

- 卡爾費休法的應用范圍----阿拉丁試劑
- 卡爾費休法可用于廣泛的物質。然而,該方法依賴于卡爾費休試劑和水之間反應的碘量測定。因此,如果樣品包含與碘單質反應的物質,結果將會出現正誤差,如果樣品包含通過氧化碘化合物產生碘單質的物質,結果將顯示負誤
-

- 傅-克酰基化反應----阿拉丁試劑
- 傅-克酰基化反應是指一類在路易斯酸作為催化劑的條件下,芳烴與酰氯或酸酐進行酰化的反應。
-

- DNA損傷和修復----阿拉丁試劑
- 細胞DNA的損傷與突變和癌癥的發生有關。人類細胞中的DNA每天要經歷數千到數百萬次的破壞事件,這些事件是由外部(外源性)和內部代謝(內源性)過程產生的。
-

- 如何提高鋰離子電池中電解液的安全性?----阿拉丁試劑
- 鋰離子電池作為一種流行的儲能設備,正被廣泛應用于便攜式電子設備、電動汽車、大型儲能電站等動力領域[1-3]。
-

- 專欄 | LC-MS/MS在濫用藥物篩查和治 療藥物監測中的應用
- 目前我國急性中毒高發,毒物種類多元,重癥中毒患者病死率高,使急診醫師面臨諸多棘手的問題和困難。可點擊之前內容“臨床質譜先鋒應用專欄 | 與死神賽跑,質譜助力中毒救治”查看。
-

- 卡爾費休庫侖法和容量法之間的區別----阿拉丁試劑
- 卡爾費休(KF)滴定法是一種具體的水分測定技術,被工業和科學家廣泛使用。根據其產生碘的方式不同,可以分為庫侖法和容量法兩種。
①本文由儀器網入駐的作者或注冊的會員撰寫并發布,觀點僅代表作者本人,不代表儀器網立場。若內容侵犯到您的合法權益,請及時告訴,我們立即通知作者,并馬上刪除。
②凡本網注明"來源:儀器網"的所有作品,版權均屬于儀器網,轉載時須經本網同意,并請注明儀器網(www.ghhbs.com.cn)。
③本網轉載并注明來源的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點或證實其內容的真實性,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品來源,并自負版權等法律責任。
④若本站內容侵犯到您的合法權益,請及時告訴,我們馬上修改或刪除。郵箱:hezou_yiqi



















參與評論
登錄后參與評論