基于定量成像信號傳導的干細胞來源心肌細胞自適應脈動流
體內內皮細胞(EC)持續暴露于血流的機械微環境中,流體剪切力在EC行為中發揮著重要作用。需要產生生理和病理相關搏動流的新方法來理解不同剪切力下EC行為。本文展示了一種自適應泵(Adapt-Pump)平臺,通過基于定量成像的信號傳導,從人多能干細胞衍生的心臟球體(CS)中產生搏動流/脈動流。Adapt-Pump系統產生的搏動流可以重現獨特的CS收縮特性,準確模擬對臨床相關藥物的反應,并模擬CS在流體機械刺激下的收縮變化。我們發現,在長QT綜合征衍生的病理性搏動流下分化的EC表現出異常的EC單層組織。這種Adapt-Pump平臺為心血管系統建模和提高我們對不同機械微環境下EC行為的理解提供了一種強大的工具。

體內血管微環境包括持續暴露于血流剪切力,這在血管形成和維持血管功能方面發揮著重要作用。搏動性血流由左心室周期性收縮產生,并維持在整個動脈以及靜脈和毛細血管的特定區域。血流與心室收縮緊密相關,因此心律失常會影響外周血流模式。內皮細胞(ECs)排列在血管腔內,因此與恒定流相比,搏動性血流為這些ECs提供了更相關的體內微環境。大量研究表明,體外搏動性血流和恒定流對ECs有不同的影響,包括EC形態和排列、基因表達、粘附蛋白分布、細胞增殖和凋亡。搏動性血流的脈動頻率和峰值振幅也在EC形態和蛋白表達方面發揮著重要作用。此外,流體剪切力顯著影響分化和分化后的血管壁。在分化過程中,脈動剪切力的影響尚未得到很好的表征。EC分化涉及多個血管形成過程,包括血管發生和血管生成,而這些新的血管形成過程受到剪切力的關鍵影響。EC在心血管系統中有多種功能,包括屏障保護、內分泌信號和炎癥反應。EC功能障礙可導致動脈粥樣硬化和血栓形成等血管疾病,以及心肌梗死和卒中。因此,開發具有更生物學相關的脈動流廓線的心血管模型,以更好地模擬血管發育和疾病,是非常重要的。
搏動性血流由于其對細胞和組織的生物力學效應,是體外研究血管生物學的關鍵組成部分。以前體外研究內皮細胞行為的方法使用氣動或壓電壓力泵和模擬波形產生搏動性血流。然而,這些以前方法的基礎泵技術缺乏時間分辨率,無法重現心臟收縮產生的時變血流的頻率內容。此外,這些以前研究的模擬搏動波形不能提供反饋流或藥物治療引起的波形實時變化。因此,這些以前的方法無法在體外研究動態生物力學變化對心血管系統的長期影響。雖然以前的研究表明,與恒定血流相比,搏動性血流改變了內皮細胞的功能和形態,但由于目前體外模型的局限性,無法確定病理性搏動性血流(如長QT綜合征)對內皮細胞的患者特異性影響。因此,需要一種新的體外模型來產生脈動流,以捕捉藥物治療或患者特異性病理流的細微流體差異,以促進心血管系統的藥物篩選和疾病建模。
人類多能干細胞(hPSC)來源的心肌細胞已被用于模擬基因突變對心肌細胞功能的影響,并能夠重現病理生理學表型19。然而,這些突變對更廣泛的心血管系統(包括血管)的影響尚未在當前hPSC來源的心肌細胞疾病模型中進行研究。此外,hPSC來源的心肌細胞提供了無限的和可重復的細胞來源,以測試心肌細胞在藥物治療和機械刺激下收縮的變化。此外,它們可以用于模擬包括LQTS在內的多種心臟疾病的表型心臟收縮。心肌細胞收縮的關鍵特征,包括頻率和振幅,與搏動血流密切相關。至關重要的是,它們可以通過高速定量成像和信號轉導轉化為信號,以產生生物相關的搏動血流。
我們展示了一種新型的自適應泵(Adapt-Pump)系統,基于患者特異性hPSC衍生心臟球體(CSs)的收縮產生生理和病理相關的脈動流。我們開發了基于定量成像的信號傳導,以記錄CSs的自發周期性收縮,并以高保真度作為微流體脈動流驅動收縮波形。我們使用Adapt-Pump從不同hPSC系的CSs中產生脈動流,包括健康人胚胎干細胞(hESC)衍生的CSs和患者特異性LQTS誘導的多能干細胞(iPSC)衍生的CSs。然后,我們解決了藥物治療對CS收縮的影響,并準確地在微流體脈動流中重現這些收縮。我們還展示了實時Adapt-Pump(rtAdapt-Pump),并解決了CS收縮對微流體機械刺激的瞬時響應。Adapt-Pump還被用于將脈動流應用于EC祖細胞,我們發現LQTS衍生的脈動流在EC分化過程中誘導了異常的細胞組織。該Adapt-Pump系統可以通過基于定量成像的信號傳導從hPSC衍生的CSs產生生理或病理相關的搏動流,這是一種新技術,使心血管系統的集成模型前所未有。Adapt-Pump可用于研究心臟疾病在臨床相關藥物治療下產生的各種機械微環境下心肌細胞和EC的綜合行為。
在這里,hPSC-CSs收縮剖面的定量成像和高速微流體泵結合到Adapt-Pump系統中,以產生生物驅動的脈動流,以促進心血管系統的建模。以前產生脈動流的方法是基于慢壓泵和模擬波形,這不能完全復制ECs經歷的體內機械微環境。這里展示的Adapt-Pump系統可以重現正常和患病心臟波形之間的差異,包括高時間分辨率的可變脈動幅度、持續時間和頻率。
Adapt-Pump系統還可以捕獲心臟藥物治療后脈動流的動態變化,重現體內心臟藥物反應,并可以實時執行,以了解CS收縮的反饋機制。我們已經證明,該系統可以模擬與生物相關的脈動流。在這里,我們使用縮放因子轉換CS收縮期間橫截面積的變化,以模擬心臟脈動流的輸出壓力。我們的2D圖像不反映CS軸向尺寸的變化,因此未來可以使用3D成像來提供CS收縮的體積變化。在未來的研究中,應該考慮更復雜的計算模型,以將CS收縮轉換為特定條件下的流動力學(例如,不同的血管位置和發育階段)。與本系統未建模的脈動流動力學有關的重要因素包括與主動脈瓣的相互作用、周圍血管系統和血管彈性。
此外,通過使用0.2 mm-ibidi μslide和Z大輸入壓力1 bar,該自適應泵系統的剪切力范圍為0 dyne/cm2至約30 dyne/cm2。然而,可以通過使用更高的輸入壓力或更小的微通道來實現更高的剪切力。該系統的時間分辨率由Elveflow泵決定,其Z小響應時間為0.09秒。這些規格限制了可以用該系統測試的應用程序。此外,對于長期實驗,細胞培養基必須由Eveflow MUX再循環裝置進行再循環,該裝置具有開關閥門,可周期性地暫時中斷脈動流。
總的來說,該系統可用于模擬心臟收縮對藥物治療和體外反饋流的實時響應,研究心肌細胞和EC在與心臟疾病相關的機械微環境下的行為,并集成到生物驅動的循環系統的芯片器官系統中。基因缺陷iPSCs已被用于體外疾病建模,包括LQTS模型。我們證明了從不同hPSCs產生的3D CSs重現了其基因型的心律特征,包括ESC源CSs的正常心臟收縮和LQTS iPSC源CSs的周期性拉長收縮。心律失常導致的異常流量可能會影響EC生物學38,但現有的產生體外脈動流的技術缺乏生物相關性,因為它們使用的是合成的心臟收縮波形。我們的方法結合hPSC-CSs、高速定量圖像分析和快速信號轉導,產生適應hPSC基因型和藥物治療效果的脈動流。
體內的ECs持續暴露于脈動血流的流體機械刺激,而流體剪切力影響ECs的行為和分化。我們發現脈動流顯著提高了ECs的分化效率,這與先前的報道一致,即剪切力可以誘導ECs分化。我們還發現脈動流增加了細胞核的厚度,這與先前的報道一致,即隨著流體流動,ECs的核形狀發生變化。這些核形態學的變化可能是ECs對剪切力響應的一個指示。脈動流還增加了細胞大小,改變了內皮細胞黏附分子CD31和機械傳感器PIEZO1的分布,這表明ECs結構受到脈動流的影響。脈動,包括頻率和振幅,在EC蛋白表達和形態學中發揮重要作用。已知紊亂的流動會影響ECs的行為,包括EC周轉率、低密度脂蛋白滲透性、動脈粥樣硬化和基因表達。然而,由于缺乏與心血管疾病相關的搏動流產生方法,以前沒有對異常搏動流和EC行為之間的關系進行表征。通過本文提出的Adapt-Pump系統,LQTS產生的搏動流在EC祖細胞分化過程中被應用于EC組織,導致EC組織異常。然而,LQTS患者不會持續經歷超過48小時的異常搏動流,相反,這些患者在一生中會周期性地經歷心律失常。先天性心臟病引起的這些異常搏動流對EC生物學的長期影響尚不清楚,但我們的概念驗證EC分化研究表明,異常搏動剪切應力可以顯著影響EC行為。
這些研究中使用的hPSC-CS來源的脈動流也反映了不同心臟疾病之間波形的細微差異,這可以為研究心血管疾病和心臟藥物對心臟收縮和內皮細胞的力學后果提供一個強大的平臺。 后續對Adapt-Pump系統中細胞的分子和遺傳特征的研究可以提高我們對生理和病理條件下心臟和內皮細胞的理解,指導改善患者的治療。
脈動和穩態流是通過連接到真空泵(-1930 mbar)和空壓機(6890 mbar)的壓力控制器(Elveflow OB1 MK3)產生的。該控制器提供了重現球形收縮波形所需的快速壓力調制(9 ms響應時間,35 ms穩定時間,122 μbar壓力分辨率)。本研究中使用的控制器配置了兩個通道,輸出壓力從-900 mbar到1000 mbar。對于流量驗證研究,其中一個通道連接到儲液池,用于通過流道產生單向流動。對于長期實驗,使用了一個再循環回路,包括兩個通道,每個通道連接到一個儲液池和一個流量循環閥(Elveflow MUX Injector),這是一個6端口/2位置閥門,允許在兩種配置之間快速切換。這使得在兩個儲液池之間再循環介質時,可以通過流道保持單向流動。聚四氟乙烯PTFE管(1/16“內徑)用于在儲液池和流道之間傳輸液體介質。使用自定義腳本控制壓力控制器和流量開關,通過流道產生脈動流。所有泵控制均使用MATLAB 2018b (MathWorks)實現。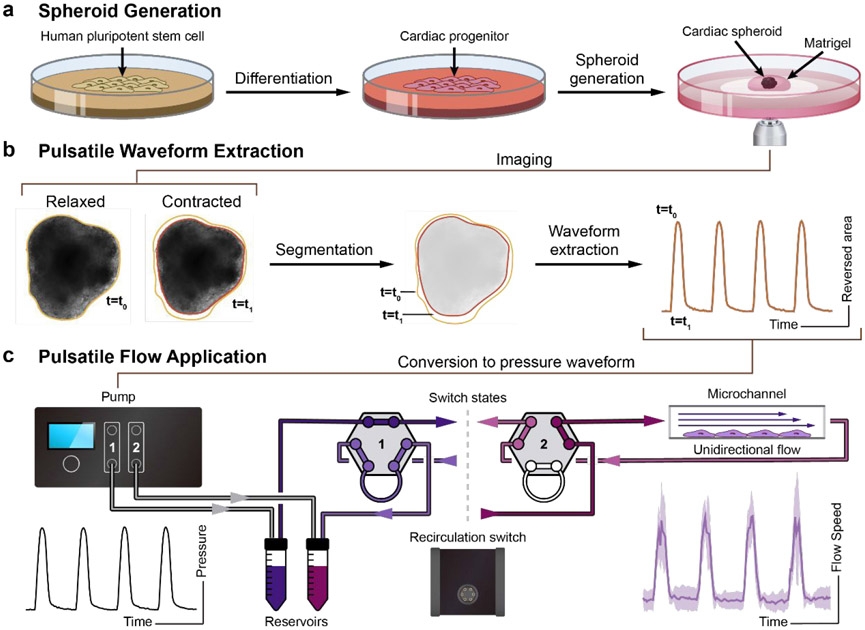
圖1:產生脈動流的工作流程示意圖。(a)奇異hPSCs在mTeSR1中播種并擴增2天。向心臟祖細胞分化遵循先前的協議,采用連續的Wnt激活和抑制。心臟球體(CS)由心臟祖細胞生成,并嵌入Matrigel中,用于進一步的心臟收縮成像。(b)hPSC衍生的CS成像。使用定制腳本分析這些時間序列圖像,并從CS收縮中提取脈動波形。(c)收縮波形轉換為脈動波形,并發送到Elveflow OB1泵。Elveflow MUX注射系統用于循環細胞培養基。流體脈動剪切應力應用于ibidi μ-slides中播種的EC祖細胞,用于EC分化研究。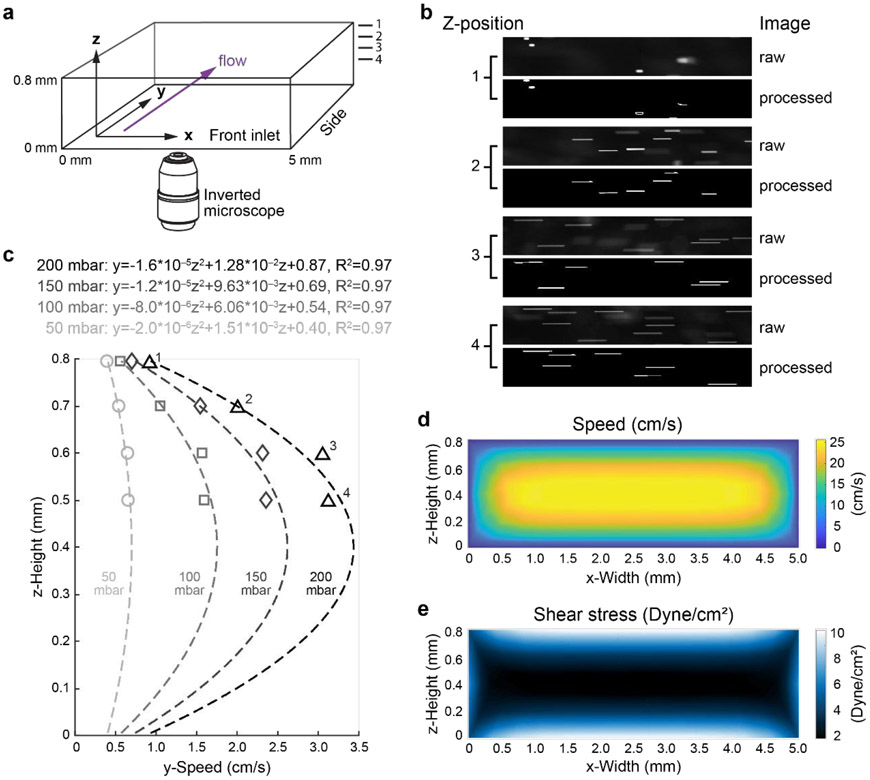
圖2:熒光珠速度測量和剪切應力模擬。(a)用于流動珠條紋測量和剪切應力模擬的ibidi μ滑動通道示意圖。尺寸標記。流向用紫色箭頭表示。Z位置為0.8 mm,0.7 mm,0.6 mm,和0.5 mm的測量標記為“1”,“2”,“3”,“4”(b)熒光珠條紋的代表性圖像(原始和圖像處理步驟后,或“處理”)從z位置0.8 mm(“1”),0.7 mm(“2”),0.6 mm(“3”),和0.5 mm(“4”)在200 mbar壓力下生成。(c)使用自定義算法計算不同通道z位置(1-4)的熒光珠速度。流道內的焦平面高度(單位:微米)為z。 壓力已標示。計算流體動力學模擬流速(d)和剪切應力(e)在800 mbar的Elveflow泵輸出分別呈現在前視圖中。
剪切力由通道頂部(z深度為795 μm)的條紋長度測量值計算得出。由于流型的對稱性,該剪切力值假定在通道底部(z深度為5 μm)是等效的。選擇z深度為5 μm是因為這是在底部表面(0 μm)播種的EC的平均厚度,因此在長期EC分化過程中,它們將處于剪切力作用的位置。輸入壓力為800 mbar時,在ibidi 0.8 mm μslide中產生的剪切力約為11 dyne/cm2(圖2c-e)。這些表征研究證實,Adapted-Pump系統可以產生不同水平的層流。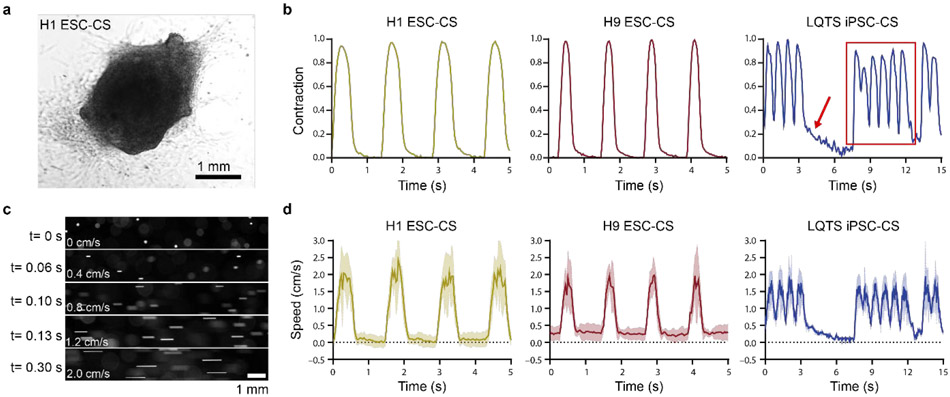
圖3. hPSC-CS收縮波形和流體脈動波形的表征。(a) H1 ESC衍生的CS的代表性明場圖像。(b) 通過定制算法提取的代表性hPSC-CS收縮波形的H1 ESC-CSs, H9 ESC-CSs和LQTS iPSC-CSs。峰值收縮幅度標準化為1。紅色箭頭表示長持續收縮,紅色矩形表示一系列快速收縮。(c) 150 mbar壓力從Erveflow泵發出,標準化收縮幅度為1。不同時間點流動珠子的代表性熒光顯微鏡圖像。(d) 使用定制算法計算流動珠子的速度,由熒光顯微鏡下H1 ESC-CSs, H9 ESC-CSs和LQTS iPSC-CSs的脈動收縮波形驅動。波形包括平均(實線)和掃描電鏡(陰影線)。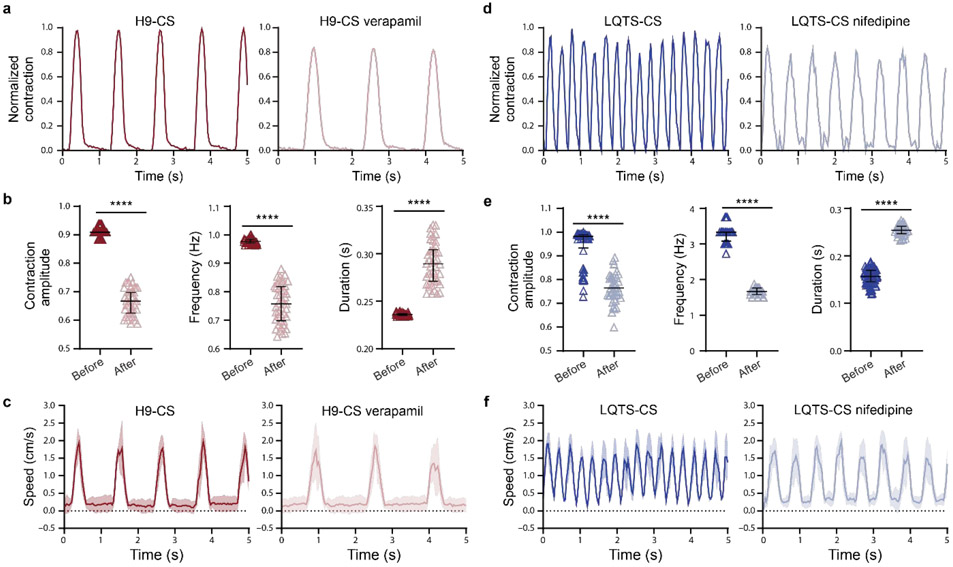
圖4. 藥物治療前后hPSC-CS收縮波形和流體脈動波形的表征。(a) 用實時顯微鏡記錄了代表性的H9 hESC-CS在1 μM verapamil治療10分鐘前后的收縮,并通過自定義算法計算。(b) 維拉帕米治療前后H9 ESC-CS的歸一化收縮幅度、收縮頻率和收縮持續時間(黑線表示平均± SEM)。收縮波形由60秒內的單個收縮計算。(c) 從Erveflow泵發出150 mbar壓力作為歸一化收縮幅度1。用實時顯微鏡記錄了代表性的珠速度,并通過自定義算法計算。(d) 用實時顯微鏡記錄了代表性的LQTS iPSC-CS在1 μM硝苯地平治療10分鐘前后的收縮,并通過自定義算法計算。(e) 硝苯地平治療前后LQTS iPSC-CS的歸一化收縮幅度、收縮頻率和收縮持續時間以平均± SEM表示。收縮波形由60秒內的單個收縮計算得出。(f)代表性珠速。兩組之間的統計顯著性由學生t檢驗(雙尾)確定。****P<0.0001。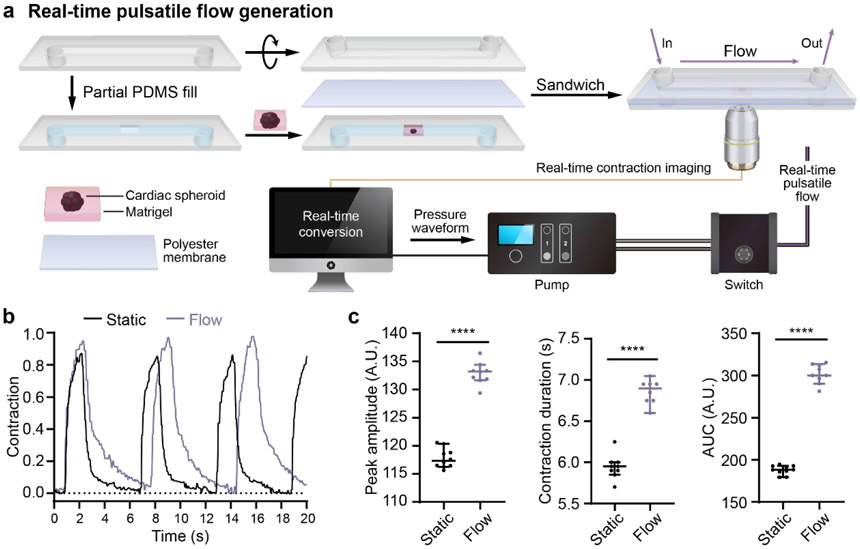
圖5. hPSC-CS對流體機械刺激的響應收縮。(a)芯片心臟模型CS收縮反饋對流體機械刺激的響應示意圖。CSs被嵌入Matrigel中并被鍍到0.8mm ibidi sticky μ-slide的微通道中(下腔)。下腔被聚酯膜密封并覆蓋另一個0.8mm ibidi sticky μ-slide(上腔)。上腔充滿了CS培養基。對于靜態條件下的收縮,CSs首先在向球體施加流體流動之前用明視野顯微鏡成像。對于流體機械刺激后的收縮響應,CSs被成像,收縮波形同時由計算機分析。脈動流信號立即被發送到泵,流體流被施加到CSs。明視野顯微鏡記錄了球體對脈動流的響應收縮。所有信號都由定制算法分析。(b)流體流動刺激前后的代表性球體收縮波形。(c)收縮的峰值收縮幅度、收縮持續時間和曲線下面積(AUC)以均值±標準差表示。所有的收縮波形均由30秒內的單個收縮計算得出。兩組之間的統計學顯著性通過學生t檢驗(雙尾)確定。****P<0.0001。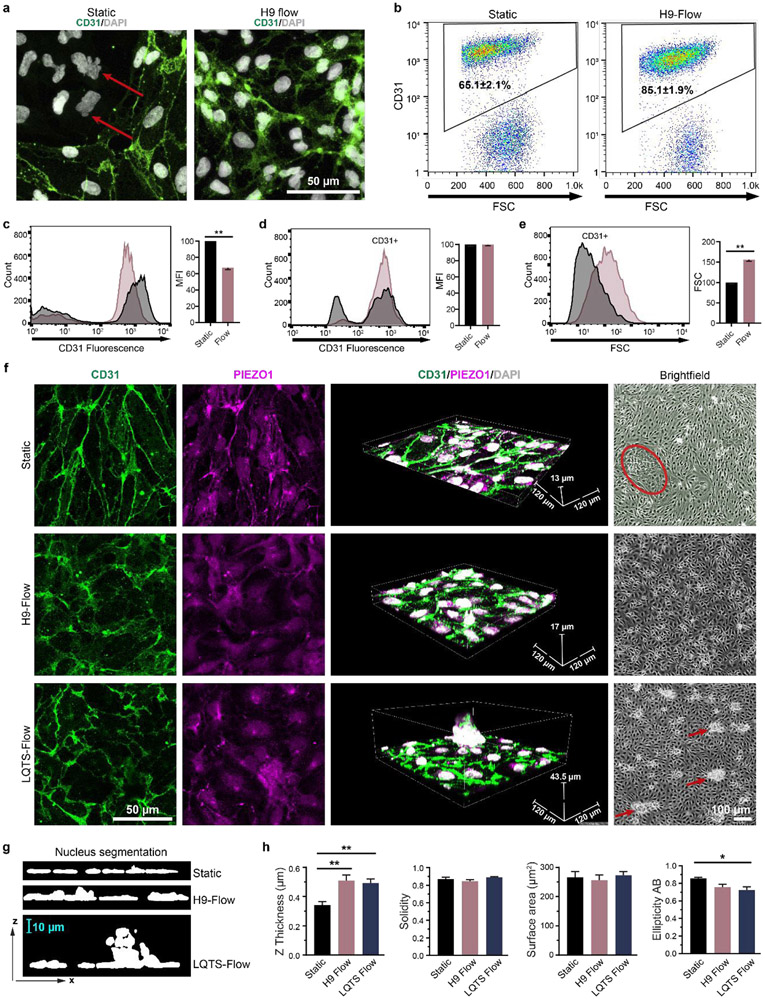
圖6. 流體脈動流影響EC分化效率和形態。(a)EC祖細胞在靜態條件下或hPSC來源的脈動流條件下分化,如圖1c所示。分化48小時后,EC用抗CD31(綠色)和DAPI(白色)進行免疫熒光標記。紅色箭頭表示非內皮細胞,(b)EC種群通過流式細胞術用CD31標記從三個獨立的生物復制量化,并表示為平均值± SEM。細胞外CD31表達水平通過流式細胞術在沒有膜滲透性的情況下量化為CD31+種群的平均熒光強度(MFI)。統計學顯著性由學生t檢驗(雙尾)(c)確定。總CD31表達(MFI)(d)和EC大小(前向散射,FSC)(e)通過流式細胞術在膜滲透性下量化。CD31+種群被門控,并顯示在直方圖中。統計學顯著性由學生t檢驗(雙尾)確定。(f)靜態條件下分化后的ECs,H9-CS源的脈動流條件,LQTS-CS源的脈動流條件。分化48小時后,ECs用抗CD31(綠色)和抗PIEZO1(品紅色)免疫熒光標記,并用DAPI(白色)染色。標記細胞用0.5 μm Z步長成像。紅色圓圈表示非內皮細胞群,紅色箭頭表示異常EC集群。(g,h)圖像在ImageJ中重建,核形態被量化。數據收集自至少三個獨立分化,并以均值±標準差繪制。統計學顯著性由單因素方差分析(ANOVA)確定,然后是Tukey事后檢驗。*p<0.05,**p<0.01。
參考文獻:
Qian T, Gil DA, Contreras Guzman E, Gastfriend BD, Tweed KE, Palecek SP, Skala MC. Adaptable pulsatile flow generated from stem cell-derived cardiomyocytes using quantitative imaging-based signal transduction. Lab Chip. 2020 Oct 21;20(20):3744-3756. doi: 10.1039/d0lc00546k. Epub 2020 Sep 7. PMID: 33048070; PMCID: PMC7699819.
相關產品
全部評論(0條)
推薦閱讀
-

- 基于自適應窗口空間方向襯比方法的血管成像方法研究
- 基于自適應窗口空間方向襯比方法的血管成像方法研究
-

- 基于自適應窗口空間方向襯比方法的血管成像方法研究
- 基于自適應窗口空間方向襯比方法的血管成像方法研究
-

- 基于白蛋白微泡介導的心肌細胞報告基因轉染機制研究
- 白蛋白微泡的理化特性,系統探討其介導心肌細胞報告基因轉染的機制。實驗利用威尼德電穿孔儀制備微泡載體,結合某試劑構建熒光素酶報告質粒,分析不同參數對轉染效率的影響。
-
- 高速攝像機小百科 | 基于自適應色溫估計算法的自動白平衡
- 高速攝像機圖像處理的重要功能-自動白平衡
-

- 基于電阻抗譜的摩擦納米電穿孔定量法
- 基于電阻抗譜的摩擦納米電穿孔定量法,突破傳統局限,建采集平臺,剖析頻譜與電穿孔關聯,助力生物醫學革新。
-
- 類髓鞘:探索神經傳導的新視角
- 類髓鞘:探索神經傳導的新視角
-
- 類髓鞘:探索神經傳導的新視角
- 類髓鞘:探索神經傳導的新視角
-
- 【行業應用】基于高光譜成像技術的包子在線檢測研究
- 應用方向:包子、高光譜成像技術、食品安全
-

- 基于微流控技術探究動態核酸雜交奧秘
- 微流控探究核酸雜交,克服傳統局限,借芯片結構、流體操控、熒光成像,精準處理樣品,助力生物醫學發展。
①本文由儀器網入駐的作者或注冊的會員撰寫并發布,觀點僅代表作者本人,不代表儀器網立場。若內容侵犯到您的合法權益,請及時告訴,我們立即通知作者,并馬上刪除。
②凡本網注明"來源:儀器網"的所有作品,版權均屬于儀器網,轉載時須經本網同意,并請注明儀器網(www.ghhbs.com.cn)。
③本網轉載并注明來源的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點或證實其內容的真實性,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品來源,并自負版權等法律責任。
④若本站內容侵犯到您的合法權益,請及時告訴,我們馬上修改或刪除。郵箱:hezou_yiqi
































參與評論
登錄后參與評論